Bài viết này tập trung vào các loại thuốc truyền tĩnh mạch để điều chỉnh huyết áp và lưu lượng máu. Các loại thuốc sau đây được mô tả gồm: dobutamine, dopamine, epinephrine, nicardipin, nitroglycerin, nitroprusside, norepinephrine và phenylephrine.
Mỗi loại được trình bày theo thứ tự bảng chữ cái.
Contents
I. DOBUTAMINE
Dobutamine là một catecholamine tổng hợp có đồng thời hai tác dụng là tăng co
bóp và dãn mạch (tức là, một inodilator).
A.Tác động
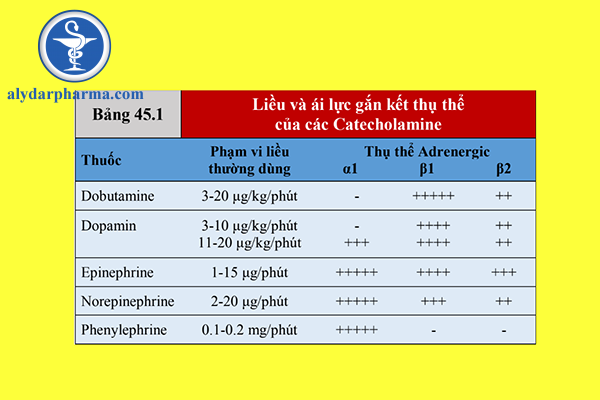
1. Dobutamine là một chất chủ vận thụ thể β-adrenergic, và liên kết với các thụ thể
β1 và β2 theo tỷ lệ 3:1 (xem Bảng 45.1) (1,2). Kích hoạt thụ thể β1 (trong cơ
tim) tạo ra các tác dụng tăng co bóp và tăng nhịp tim, trong khi kích hoạt thụ thể
β2 (trong cơ trơn mạch máu) gây dãn mạch.
2. Tác dụng chính của dobutamine bao gồm (1,2):
a. Sự gia tăng cung lượng tim phụ thuộc liều (do tăng thể tích nhát bóp nhiều
hơn tăng nhịp tim).
b. Giảm áp lực đổ đầy tâm thất.
c. Giảm kháng lực mạch máu toàn thân.
d. Huyết áp có thể giảm, không thay đổi, hoặc tăng, tùy thuộc vào sự cân bằng
giữa những thay đổi về thể tích nhát bóp và kháng lực mạch máu hệ thống.
B. Sử dụng trên lâm sàng
1. Theo hướng dẫn của Hiệp hội Tim mạch Hoa Kỳ về quản lý suy tim (3),
dobutamine nên được dành riêng cho những trường hợp rối loạn chức năng tâm
thu nặng nề đã tiến triển đến sốc tim hoặc dọa sốc. Do dobutamine không tăng
đáng kể huyết áp, nên hạ huyết áp được điều chỉnh bằng thuốc co mạch trước
khi sử dụng dobutamine.
2. Hướng dẫn của Surviving Sepsis Campaign về nhiễm trùng huyết nặng và sốc
nhiễm trùng (4) khuyến cáo dobutamine khi truyền dịch và thuốc co mạch không
bình thường hóa được độ bão hòa O2 tĩnh mạch trung tâm (xem Chương 9).
3. Dobutamine KHÔNG thích hợp để quản lý suy tim có giảm đổ đầy thất (tức là,
“suy tim tâm trương”).
C. Cách dùng dobutamine
1. Dobutamine được truyền tĩnh mạch liên tục mà không cần liều khởi đầu.
2. Tốc độ liều ban đầu là 3-5 μg/kg/phút, có thể tăng mỗi lần thêm 3-5 μg/kg/phút,
nếu cần. Ở liều cao hơn 20 μg/kg/phút, nguy cơ các tác dụng phụ thường vượt
quá lợi ích (3,4).
D.Tác dụng phụ
Các tác dụng phụ của dobutamine có liên quan đến kích thích tim:
1. Truyền dobutamine thường đi kèm với nhịp tim tăng nhẹ (10-15 nhịp/phút),
nhưng sự gia tăng nhịp tim nhiều hơn (≥30 nhịp/phút) có thể xảy ra ở những
bệnh nhân cá biệt (2). Loạn nhịp nhanh ác tính là ít gặp trong truyền dobutamine.
2. Dobutamine làm tăng tiêu thụ O2 cơ tim, có thể đẩy nhanh sự suy giảm dự trữ
năng lượng trong cơ tim đang suy. Lo ngại này là một trong những lý do mà
dobutamine chỉ được khuyến cáo như là một can thiệp ngắn hạn (≤72 giờ) (3).
II. DOPAMINE
Dopamine là một catecholamine nội sinh hoạt động như là một chất dẫn truyền thần
kinh và là tiền thân của sự tổng hợp norepinephrine. Khoảng 25% liều dopamine
được đưa vào đầu tận cùng thần kinh adrenergic và được chuyển hóa thành
norepinephrine (5).
A.Tác động
1. Tốc độ liều thấp
Ở tốc độ liều thấp (<3 μg/kg/phút), dopamine có tác dụng kích hoạt chọn lọc các
thụ thể dopamine chuyên biệt trong tuần hoàn thận và nội tạng, thúc đẩy dãn
mạch và tăng lưu lượng máu ở những vùng này (5). Tác dụng thận của dopamine
liều thấp là tối thiểu hoặc không có ở bệnh nhân suy thận cấp (6).
2. Tốc độ liều trung bình
Ở tốc độ liều trung bình (3-10 μg/kg/phút), dopamine kích thích thụ thể β ở tim
và tuần hoàn hệ thống, và tạo ra những thay đổi tim mạch rất giống với những
thay đổi được mô tả cho dobutamine.
3. Tốc độ liều cao
Ở tốc liều cao (>10 μg/kg/phút), dopamine tạo ra sự kích hoạt thụ thể β phụ
thuộc liều, dẫn đến co thắt mạch rộng rãi và tăng huyết áp tiến triển.
B. Sử dụng trên lâm sàng
Sự phổ biến của dopamine như một loại thuốc hỗ trợ huyết động đã giảm đáng
kể trong những năm gần đây do các rối loạn nhịp nhanh nguy hiểm và các báo
cáo tăng tỷ lệ tử vong liên quan đến thuốc này (7). Các vấn đề liên quan đến
việc sử dụng dopamine được tóm tắt dưới đây.
1. Dopamine liều thấp đã từng được sử dụng như một cố gắng để tăng độ lọc cầu
thận ở bệnh nhân suy thận cấp, nhưng thực hành này không đẩy nhanh quá trình
phục hồi thận (6) và từ lâu không còn được khuyến cáo nữa.
2. Dopamine không còn là thuốc vận mạch được ưu tiên trong sốc nhiễm trùng, và
chỉ được khuyến cáo cho những bệnh nhân có nhịp tim chậm tương đối hoặc
tuyệt đối và nguy cơ loạn nhịp nhanh là tối thiểu (4).
3. Dopamine là một xem xét trong sốc tim do các tác động kết hợp chủ vận α và β
có thể làm tăng huyết áp trong khi cũng cung cấp hỗ trợ tăng sức co bóp.
C. Cách sử dụng thuốc
1. Giống như mọi thuốc co mạch khác, dopamine có thể gây hoại tử mô rộng rải
nếu xảy ra thoát mạch, do đó thuốc nên được truyền vào tĩnh mạch trung tâm,
lớn.
2. Dopamine được truyền tĩnh mạch liên tục, không có liều nạp ban đầu.
a. Tốc độ liều ban đầu là 3-5 μg/kg/phút, và có thể được điều chỉnh lên mỗi vài
phút, nếu cần thiết, để đạt được hiệu quả mong muốn.
b. Tốc độ liều 3-10 μg/kg/phút là tối ưu để tăng cung lượng tim.
c. Tốc độ liều >10 μg/kg/phút thường là cần thiết để nâng huyết áp.
d. Tốc độ liều tối đa thường là 20 μg/kg/phút; tốc độ liều cao hơn thường đi
kèm với gia tăng nhịp tim nhanh không mong muốn mà không tăng thêm tác
dụng vận mạch.
D.Tác dụng phụ
1. Nhịp tim nhanh là tác dụng phụ thường gặp nhất; nhanh xoang và rung nhĩ được
báo cáo ở 25%bệnh nhân được truyền dopamine (7).
2. Tác dụng phụ khác của dopamine bao gồm hoại thư các ngón (5), giảm tưới máu
cơ quan (5), tăng nhãn áp (9), và chậm làm rỗng dạ dày (10).
III.EPINEPHRINE
Epinephrine là một catecholamine nội sinh được phóng thích bởi tủy thượng thận
để đáp ứng với stress sinh lý. Nó là thuốc có tính chủ vận β mạnh nhất.
A. Tác động
1. Epinephrine là một chất chủ vận thụ thể α và β không chọn lọc, và tạo ra sự gia
tăng nhịp tim, thể tích nhát bóp và huyết áp phụ thuộc liều (11,12).
2. Kích thích thụ thể β tạo ra sự co mạch ngoại vi không đồng bộ, với tác dụng nổi
bật nhất trong tuần hoàn dưới da, thận và nội tạng. Nguy cơ thiếu máu cục bộ
cơ quan là một trong những lo ngại chính với việc dùng epinephrine (12).
3. Epinephrine có các tác dụng chuyển hóa sau (11,12):
a. Kích hoạt thụ thể β thúc đẩy ly giải mỡ và glucose, và làm tăng sản xuất
lactate; tác dụng này thường đi kèm với tăng lactate máu. (Những tác dụng
này không nổi bật với các tác dụng khác, ít mạnh hơn, chủ vận β.)
b. Kích thích thụ thể β ức chế bài tiết insulin và làm tăng đường huyết.
B. Sử dụng trên lâm sàng
1. Epinephrine là thuốc đầu tay trong hồi sức ngừng tim và sốc phản vệ (xem
Chương 9 và 15).
2. Epinephrine cũng là một loại thuốc hỗ trợ huyết động phổ biến trong giai đoạn đầu hậu phẫu có tim phổi nhân tạo.
3. Lo ngại về nguy cơ tác dụng phụ đã hạn chế sự phổ biến của epinephrine như
một thuốc vận mạch trong sốc nhiễm trùng, và nó thường được dành riêng cho
các trường hợp kháng trị với các thuốc vận mạch thông thường (ví dụ,
norepinephrine) (12).
C. Cách sử dụng thuốc
1. Do các tác động co mạch của nó, epinephrine nên được truyền vào tĩnh mạch
trung tâm, lớn.
2. Các phác đồ về liều epinephrine để hỗ trợ tuần hoàn như sau (11):
a. NGỪNG TIM: tiêm mạch 1 mg bolus mỗi 3-5 phút cho đến khi có lại tuần
hoàn tự phát.
b. SỐC PHẢN VỆ: Bắt đầu truyền liều 5 μg/phút và tăng tốc độ liều thêm 2-5
μg/phút, nếu cần, để đạt được huyết áp mục tiêu. Phạm vi liều thông thường
là 5-15 μg/phút.
c. SỐC NHIỄM TRÙNG HOẶC HỖ TRỢ TUẦN HOÀN SAU TIM PHỔI
NHÂN TẠO: Bắt đầu truyền liều 1-2 μg/phút, và tăng tốc độ liều thêm 1-2
μg/phút, nếu cần thiết, để đạt được huyết áp mong muốn. Phạm vi liều thông
thường là 1-10 μg/phút.
D.Tác dụng phụ
1. Tác dụng phụ của epinephrine bao gồm nhịp tim nhanh (nguy cơ lớn hơn so với
các thuốc catecholamine khác), tăng đường huyết, tăng chuyển hóa với tăng nhu
cầu O2 toàn cơ thể, và thiếu máu cục bộ các cơ quan (11,12).
2. Tăng lactate máu liên quan epinephrine không được xem là một tác dụng phụ
bởi vì nó phản ánh tốc độ gia tăng ly giải glucose, không phải thiếu oxy mô, và
lactate có thể được sử dụng để tân tạo glucsoe tại gan (chu trình Cori).
IV. NICARDIPINE
Nicardipin là chất chẹn kênh calci hoạt động như một thuốc chống tăng huyết áp.
A.Tác động
1. Nicardipine gây dãn mạch bằng cách ức chế dòng calci đi vào tế bào cơ trơn
mạch máu (13).
2. Thuốc dãn mạch có tác dụng không đồng đều và tác dụng lớn nhất trong tuần
hoàn não (13,14).
3. Nicardipine có tác dụng làm giảm sức co bóp cơ tim, nhưng không ảnh hưởng
đến chức năng của nút xoang hoặc nút AV (14).
B. Sử dụng trên lâm sàng
1. Nicardipine được sử dụng để kiểm soát nhanh tăng huyết áp đáng lo ngại, bao
gồm tăng huyết áp sau phẫu thuật (15), và tăng huyết áp cấp cứu (16). Nó cũng
là thuốc đầu tay trong những trường hợp đột quỵ thiếu máu cục bộ cấp đòi hỏi
phải hạ huyết áp khẩn cấp để cho phép điều trị tiêu huyết khối (17).
C. Cách sử dụng thuốc
1. Nicardipine có sẵn như là một loại thuốc uống, nhưng sử dụng dạng truyền tĩnh
mạch liên tục để nhanh chóng kiểm soát huyết áp. Thuốc có thể được sử dụng
một cách an toàn qua tĩnh mạch ngoại biên.
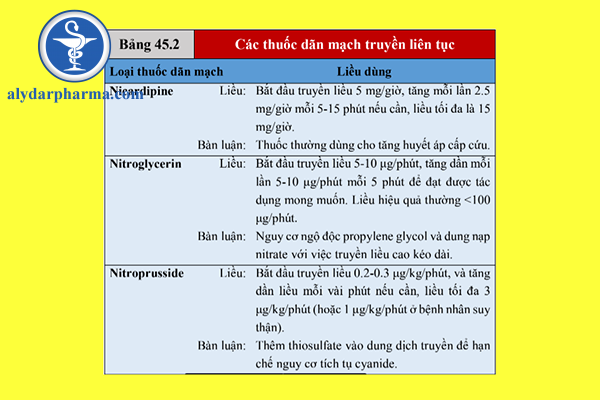
2. Tốc độ truyền ban đầu là 5 mg/giờ, và tốc độ này có thể được tăng lên mỗi lần
2.5 mg/giờ sau mỗi 5-10 phút, nếu cần thiết, đến liều tối đa 15 mg/giờ (18).
3. Mặc dù nicardipine được chuyển hóa ở gan và bài tiết trong nước tiểu, nhưng
không cần điều chỉnh liều đối với người suy gan hoặc suy thận (18).
D. Tác dụng phụ
1. Các tác dụng phụ thường gặp bao gồm nhức đầu, đỏ bừng mặt, hạ huyết áp, và
nhịp tim nhanh (phản xạ) (16,18).
2. Nicardipine có thể làm hạ huyết áp sâu sắc ở bệnh nhân hẹp động mạch chủ tiến
triển, và thuốc bị chống chỉ định trong tình trạng này (18).
V. NITROGLYCERIN
Nitroglycerin (NTG) là một nitrate hữu cơ (glyceryl trinitrate) và là thuốc gây dãn
mạch, kháng tiểu cầu và có tác dụng chống đau thắt ngực.
A.Tác động
1. Tác dụng dãn mạch
a. NTG hoạt động như một thuốc dãn mạch do nó chuyển thành nitric oxide,
làm tăng cường sự thư giãn của cơ trơn mạch máu (19).
b. Tác dụng dãn mạch của NTG phụ thuộc liều, và tác dụng trên cả động mạch
lẫn tĩnh mạch; tác dụng dãn tĩnh mạch là nổi bật ở liều thấp (<50 μg/phút),
trong khi tác dụng dãn động mạch chiếm ưu thế ở liều cao hơn (20,21).
c. Ở liều thấp, NTG làm giảm áp lực đổ đầy tim mà không có hoặc rất ít thay
đổi cung lượng tim (20). Khi liều tăng lên, cung lượng tim bắt đầu tăng lên
do các tác dụng dãn động mạch. Ban đầu huyết áp có thể không thay đổi,
nhưng liều gia tăng dần đến mức sẽ làm giảm huyết áp.
2. Tác dụng kháng tiểu cẩu
Việc chuyển NTG thành nitric oxide dẫn đến sự ức chế kết tập tiểu cầu, và tác
dụng này có thể được dùng để chống đau thắt ngực với NTG (22).
B. Sử dụng trên lâm sàng
1. NTG có 3 mục đích sử dụng chính ở bệnh nhân nặng:
a. Tăng cung lượng tim ở bệnh nhân suy tim mất bù cấp.
b. Giảm đau ngực ở bệnh nhân đau thắt ngực không ổn định.
c. Điều trị tăng huyết áp cấp cứu.
C. Cách sử dụng thuốc
1. Hấp thụ vào nhựa
a. Khoảng 80% NTG trong dịch truyền có thể bị mất do polyvinylchloride
(PVC) hấp thụ trong các hệ thống truyền tĩnh mạch tiêu chuẩn (21).
b. NTG không liên kết với thủy tinh hoặc nhựa cứng như polyethylene (PET),
do đó việc mất thuốc qua hấp thụ có thể được loại bỏ bằng cách sử dụng chai
thủy tinh và ống PET.
2. Liều dùng
a. NTG nên được bắt đầu với liều 5-10 μg/phút. Sau đó, tốc độ tăng lên mỗi lần
5-10 μg/phút mỗi 5 phút cho đến khi đạt được hiệu quả mong muốn.
b. Liều hiệu quả thường là ≤100 μg/phút.
D.Tác dụng phụ
1. Tác dụng huyết động không mong muốn
a. Dãn tĩnh mạch do NTG có thể gây hạ huyết áp ở những bệnh nhân bị giảm
thể tích tuần hoàn hoặc suy tim phải. Trong những tình trạng thế này, bù thể
tích là cần thiết trước khi truyền NTG.
b. NTG cũng có thể gây ra tình trạng tụt huyết áp thê thảm ở bệnh nhân đã dùng
thuốc ức chế phosphodiesterase vì rối loạn chức năng cương dương trong
vòng 24 giờ qua (20).
c. Lưu lượng máu não tăng do NTG có thể dẫn đến tăng áp lực nội sọ (23).
d. Ở bệnh nhân ARDS, tác dụng dãn mạch phổi của NTG có thể dẫn đến sự gia
tăng shunt trong phổi và hậu quả là giảm oxy hóa máu động mạch (24).
2. Methemoglobin
Chuyển hóa NTG tạo ra nitrite vô cơ, có thể oxy hóa một phần sắt trong
hemoglobin để tạo ra methemoglobin. Tuy nhiên, methemoglobin máu có triệu
chứng không phải là biến chứng thường gặp của truyền NTG, và chỉ xảy ra với
truyền kéo dài ở liều cao (23).
3. Độc tính của dung môi
NTG không hòa dễ tan trong dung dịch nước, và các dung môi không phân cực
như ethanol và propylen glycol là cần thiết để giữ thuốc trong dung dịch. Các
dung môi này có thể tích tụ trong quá trình truyền kéo dài.
a. Cả ngộ độc ethanol (25) và ngộ độc propylene glycol (26) đều đã được báo
cáo như là hậu quả của truyền NTG.
b. Ngộ độc propylen glycol là một lo ngại đặc biệt vì dung môi này chiếm 30-
50% trong một số chế phẩm NTG (23). (Ngộ độc propylene glycol được mô
tả trong Chương 24, Phần I-A-5.)
E. Dung nạp Nitrate
1. Dung nạp với tác dụng dãn mạch và kháng tiểu cầu của NTG có thể xuất hiện
sau 24 giờ dùng thuốc liên tục (23,27). Cơ chế nền tảng có thể liên quan đến rối
loạn chức năng nội mô do oxy hóa (27).
2. Phương pháp hiệu quả nhất để phòng ngừa hoặc đảo ngược sự dung nạp nitrate
là một khoảng thời gian không thuốc hàng ngày ít nhất 6 giờ (23).
VI. NITROPRUSSIDE
Nitroprusside (NTP) là một thuốc dãn mạch tác dụng nhanh có xu hướng nguy hiểm
do thúc đẩy tích tụ cyanide.
A. Tác động
1. Tác dụng dãn mạch của NTP, giống như của nitroglycerin, qua trung gian nitric
oxide (19). NTP làm dãn cả động mạch và tĩnh mạch, nhưng tác dụng dãn tĩnh
mạch của nó yếu hơn nitroglycerin, và tác dụng dãn động mạch thì mạnh hơn.
2. NTP có tác dụng khác nhau trên cung lượng tim ở bệnh nhân có chức năng tim
bình thường (28), nhưng nó làm tăng cung lượng tim ở bệnh nhân suy tim mất
bù (29).
B. Gánh nặng Cyanide
1. Phân tử NTP là phức hợp ferricyanide chứa 5 nguyên tử cyanide (CN) gắn với
lõi sắt bị oxy hóa, và một phần cyanide này được phóng thích vào máu khi sử
dụng NTP với tác dụng giãn mạch.
2. Các cơ chế thúc đẩy thanh thải cyanide được mô tả trong Chương 47 (xem
Phương trình 47.1 và 47.2).
a. Cơ chế chính để thải CN liên quan đến việc chuyển các ion sulfate từ
thiosulfate (S2O3) đến CN để tạo ra thiocyanate (SCN), sau đó được thải ra
bởi thận. Người lớn khỏe mạnh có đủ thiosulfate nội sinh để giải độc cho
khoảng 68 mg NTP (23); với tốc độ truyền NTP 2 μg/kg/phút (giới hạn cao
của điều trị) ở người lớn 80 kg, thì khả năng giải độc cho 68 mg NTP sẽ bị
mất chỉ sau 500 phút (8.3 giờ).
b. Cơ chế đào thải phụ (nhỏ) của CN liên quan đến việc liên kết CN với
methemoglobin để tạo thành cyanomethemoglobin.
C. Sử dụng trên lâm sàng
1. NTP được sử dụng chủ yếu trong những tình trạng mong muốn giảm nhanh
huyết áp (ví dụ: tăng huyết áp cấp cứu, bóc tách động mạch chủ cấp tính).
2. NTP cũng được sử dụng trong quản lý ngắn hạn suy tim mất bù cấp (29).
3. Mặc dù NTP đã được chứng minh là một thuốc dãn mạch hiệu quả, nhưng khả
năng ngộ độc cyanide đã làm giảm đáng kể mức độ phổ biến của thuốc này (30).
D. Cách sử dụng thuốc
1. Thiosulfate phải được thêm vào truyền dịch NTP để hạn chế sự tích tụ CN.
Khoảng 500 mg thiosulfate nên được thêm vào cho mỗi 50 mg NTP (31).
2. Truyền NTP được bắt đầu ở liều 0.2-0.3 μg/kg/phút, và sau đó chỉnh liều lên
mỗi vài phút để đạt được hiệu quả mong muốn. Tốc độ liều không được vượt
quá 3 μg/kg/phút (31), để hạn chế sự tích tụ cyanide.
3. Trong suy thận, tốc độ liều NTP không được vượt quá 1 μg/kg/phút (31), để hạn
chế nguy cơ ngộ độc thiocyanate (xem sau).
E. Ngộ độc Cyanide
1. Biểu hiện lâm sàng và quản lý ngộ độc CN được mô tả trong Chương 47 (xem
Phần II và Bảng 47.1).
2. Một trong những dấu hiệu sớm của ngộ độc CN trong quá trình truyền NTP là
sự gia tăng nhanh nhu cầu về liều NTP (miễn dịch nhanh) (23). Dấu hiệu suy
yếu việc sử dụng oxy (ví dụ, nhiễm toan lactic) không xuất hiện cho đến giai
đoạn cuối của ngộ độc CN (31).
F. Ngộ độc Thiocyanate
1. Khi chức năng thận bị suy yếu, thiocyanate có thể tích lũy và tạo ra một hội
chứng độc thần kinh đặc trưng bởi kích động, ảo giác, co giật toàn thân, ù tai và
co thắt đồng tử (32). Hình ảnh lâm sàng này có thể khó phân biệt với ngộ độc
CN; Tuy nhiên, ngộ độc thiocyanate không kèm theo nhiễm toan chuyển hóa
(mà đây là đặc tính của ngộ độc CN).
2. Chẩn đoán được xác định bằng nồng độ thiocyanate huyết thanh. Mức bình
thường là dưới 10 mg/L, và mức trên 100 mg/L có liên quan đến ngộ độc trên
lâm sàng (32).
3. Ngộ độc thiocyanate có thể được điều trị bằng thẩm tách máu.
VII. NOREPINEPHRINE
Norepinephrine là một catecholamine nội sinh phục vụ như một chất dẫn truyền
thần kinh kích thích. Trên lâm sàng, norepinephrine được sử dụng vì khả năng thúc
đẩy co mạch rộng rãi của nó.
A. Tác động
1. Norepinephrine là một chất chủ vận thụ thể β là chính, và là một chất chủ vận
thụ thể β1 nhẹ. Tác dụng chung là co mạch hệ thống với ảnh hưởng khác nhau
trên cung lượng tim (33).
2. Đáp ứng co mạch với norepinephrine thường đi kèm với sự giảm lưu lượng máu
thận (33). Đây không phải là trường hợp trong sốc nhiễm trùng, trong đó lưu
lượng máu thận được bảo tồn (hoặc tăng nhẹ) trong quá trình truyền
norepinephrine (34,35).
B. Sử dụng trên lâm sàng
Norepinephrine hiện được ưu tiên hơn dopamine để điều trị vận mạch trong sốc
nhiễm trùng (36). Sự ưu tiên này dựa trên các nghiên cứu cho thấy ít tác dụng
phụ hơn (7) và tỷ lệ tử vong thấp hơn (4,36) khi sử dụng norepinephrine thay vì
dopamine trong sốc nhiễm trùng.
C. Cách sử dụng thuốc
1. Giống như các thuốc co mạch, norepinephrine nên được truyền qua một tĩnh
mạch trung tâm lớn.
2. Norepinephrine được truyền liên tục mà không cần liều nạp. Liều khởi đầu 2-3
μg/phút, và liều này có thể tăng lên mỗi lần 2-3 μg/phút mỗi vài phút, nếu cần,
để đạt được đáp ứng mong muốn.
3. Liều hiệu quả có thể thay đổi rất nhiều ở từng bệnh nhân. Khoảng liều thường
dùng là 2-20 μg/phút và tốc độ liều trên 40 μg/phút không được khuyến cáo (33).
D. Tác dụng phụ
Các tác dụng phụ của norepinephrine chủ yếu liên quan đến việc co mạch quá
mạnh mẽ, có thể gây ra giảm tưới máu trong các cơ quan quan trọng (đặc biệt là
ruột và thận) và cũng có thể tạo ra nhịp tim chậm phản xạ. Những tác dụng phụ
này được làm trầm trọng thêm bởi giảm thể tích tuần hoàn.
VIII. PHENYLEPHRINE
Phenylephrine là một chất co mạch mạnh có vài ưu điểm và một số nhược điểm khi
so sánh với các thuốc co mạch khác.
A.Tác động
Phenylephrine là một chất chủ vận thụ thể β thuần túy, tạo ra sự co mạch mạnh
và rộng rải. Tác dụng này thường đi kèm với nhịp tim chậm phản xạ và giảm
cung lượng tim (37).
B. Sử dụng trên lâm sàng
1. Phenylephrine được dùng chủ yếu là để đảo ngược tình trạng hạ huyết áp do gây
tê tủy sống. Tuy nhiên, các chất chủ vận thụ thể β thuần túy không được quá ưa
chuộng trong tình huống này bởi vì chúng có thể làm trầm trọng thêm tình trạng
giảm cung lượng tim liên quan gây tê tủy sống (37).
2. Phenylephrine KHÔNG được khuyến cáo dùng cho mục đích hỗ trợ vận mạch
trong sốc nhiễm trùng do tác dụng có hại của nó lên cung lượng tim và tưới máu
thận (4).
C. Cách sử dụng thuốc
1. Phenylephrine có thể được tiêm tĩnh mạch chậm; liều ban đầu là 0.2 mg (200
μg), và có thể được lặp lại sau mỗi 5-10 phút, sử dụng liều tăng dần mỗi lần 0.1
mg cho đến liều tối đa là 0.5 mg (37).
2. Phenylephrine cũng có thể được truyền với liều 0.1-0.2 mg/phút, chỉnh liều
xuống càng sớm càng tốt (37).
D.Tác dụng phụ
Các tác dụng phụ của phenylephrine có liên quan đến sự co mạch mạnh mẽ, và
bao gồm nhịp tim chậm phản xạ, cung lượng tim thấp gây ra giảm tưới máu các
cơ quan quan trọng. Những tác dụng này được tăng thêm bởi sự giảm thể tích
thuần hoàn.
TÀI LIỆU THAM KHẢO
1. Overgaard CB, Dzavik V. Inotropes and vasopressors: review of physiology
and clinical use in cardiovascular disease. Circu-lation 2008; 118:1047–1056.
2. Dobutamine hydrochloride. In McEvoy GK, ed. AHFS Drug Information, 2014.
Bethesda: American Society of Health-System Pharmacists, 2014:1350–1352.
3. Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the
management of heart failure: a report of the American College of Cardiology
Foundation/American Heart Association Task Force on Practice Guidelines. J
AmColl Cardiol 2013; 62:e147–e239.
4. Dellinger RP, Levy MM, Rhodes A, et al. Surviving Sepsis Campaign:
International guidelines for management of severe sepsis and septic shock. Crit
Care Med 2013; 41:580–637.
5. Dopamine Hydrochloride. In McEvoy GK, ed. AHFS Drug Information, 2014.
Bethesda: American Society of Health-System Pharmacists, 2014:1352–1356.
6. Kellum JA, Decker JM. Use of dopamine in acute renal failure: A meta-
analysis. Crit Care Med 2001; 29:1526–1531.
7. De Backer D, Biston P, Devriendt J, et al. Comparison of dopamine and
norepinephrine in the treatment of shock. N Engl J Med 2010; 362:779–789.
8. Ellender TJ, Skinner JC. The use of vasopressors and inotropes in the emergency
medical treatment of shock. Emerg Med Clin N Am 2008; 26:759–786.
9. Brath PC, MacGregor DA, Ford JG, Prielipp RC. Dopamine and intraocular
pressure in critically ill patients. Anesthesiology 2000; 93:1398–1400.
10. Johnson AG. Source of infection in nosocomial pneumonia. Lancet 1993;
341:1368 (Letter).
11. Epinephrine. In McEvoy GK, ed. AHFS Drug Information, 2014. Bethesda:
American Society of Health-SystemPharmacists, 2014:1402–1408.
12. Levy B. Bench-to-bedside review: Is there a place for epinephrine in septic
shock? Crit Care 2005; 9:561–565.
13. Amenta F, Tomassoni D, Traini E, et al. Nicardipine: a hypotensive
dihydropyridine-type calcium antagonist with a peculiar cerebrovascular
profile. Clinical and Experimental Hypertension 2008; 30:808–826.
14. Struyker-Boudier HAJ, Smits JFM, De Mey JGR. The pharmacology of calcium
antagonists: a review. J Cardiovasc Pharmacol 1990; 15 (Suppl. 4):S1–S10.
15. Kaplan JA. Clinical considerations for the use of intravenous nicardipine in
the treatment of postoperative hypertension. Am Heart J 1990; 119:443–6.
16. Peacock WF, Hilleman DE, Levy PD, et al. A systematic review of nicardipine
vs. labetalol for the management of hypertensive crises. Am J Emerg Med 2012;
30:981–993.
17. Ayagari V, Gorelick PB. Management of blood pressure for acute and recurrent
stroke. Stroke 2009; 40:2251–2256.
18. Nicardipine hydrochloride [package insert]. Bedminster, NJ: EKR Therapeutics,
Inc., 2010.
19. Anderson TJ, Meredith IT, Ganz P, et al. Nitric oxide and nitrovasodilators:
similarities, differences and potential interactions. J Am Coll Cardiol 1994;
24:555–566.
20. Nitroglycerin. In: McEvoy GK, ed. AHFS Drug Information, 2014. Bethesda:
American Society of HealthSystemPharmacists, 2014:1860–1863.
21. Elkayam U. Nitrates in heart failure. Cardiol Clin 1994; 12:73–85.
22. Stamler JS, Loscalzo J. The antiplatelet effects of organic nitrates and related
nitroso compounds in vitro and in vivo and their relevance to cardiovascular
disorders. J Am Coll Cardiol 1991; 18:1529–1536.
23. Curry SC, Arnold-Cappell P. Nitroprusside, nitroglycerin, and angiotensin-
converting enzyme inhibitors. In: Blumer JL, Bond GR, eds. Toxic effects of drugs used in the ICU. Crit Care Clin 1991; 7:555–582.
24. Radermacher P, SantakB, Becker H, Falke KJ. Prostaglandin F1 and nitroglycerin
reduce pulmonary capillary pressure but worsen ventilation–perfusion
distribution in patients with adult respiratory distress syndrome.
Anesthesiology 1989; 70:601–606.
25. Korn SH, Comer JB. Intravenous nitroglycerin and ethanol intoxication.
Ann Intern Med 1985; 102:274.
26. Demey HE, Daelemans RA, Verpooten GA, et al. Propylene glycol-induced
side effects during intravenous nitroglycerin therapy. Intensive Care Med 1988;
14:221–226.
27. Münzel T, Gori T. Nitrate therapy and nitrate tolerance in patients with coronary
artery disease. Curr Opin Pharmacol 2013; 13:251–259.
28. Sodium Nitroprusside. In: McEvoy GK, ed. AHFS Drug Information, 2014.
Bethesda: American Society of Health SystemPharmacists, 2014:1848–1851.
29. Guiha NH, Cohn JN, Mikulic E, et al. Treatment of refractory heart
failure with infusion of nitroprusside. New Engl J Med 1974; 291:587–592.
30. Robin ED, McCauley R. Nitroprusside-related cyanide poisoning. Time (long
past due) for urgent, effective interventions. Chest 1992; 102:1842–1845.
31. Hall VA, Guest JM. Sodium nitroprusside-induced cyanide intoxication and
prevention with sodium thiosulfate prophylaxis. Am J Crit Care 1992; 2:19–27.
32. Apple FS, Lowe MC, Googins MK, Kloss J. Serum thiocyanate concentrations
in patients with normal or impaired renal function receiving nitroprusside. Clin
Chem 1996; 42:1878–1879.
33. Norepinephrine Bitartrate. In: McEvoy GK, ed. AHFS Drug Information, 2014.
Bethesda: American Society of Health System Pharmacists, 2014:1410–1413.
34. Bellomo R, Wan L, May C. Vasoactive drugs and acute kidney injury.
Crit Care Med 2008; 36(Suppl):S179–S186.
35. Desairs P, Pinaud M, Bugnon D, Tasseau F. Norepinephrine therapy has no
deleterious renal effects in human septic shock. Crit Care Med 1989; 17:426–
429.
36. Fawzy A, Evans SR, Walkey AJ. Practice patterns and outcomes associated
with choice of initial vasopressor therapy for septic shock. Crit Care Med 2015;
43:2141–2146.
37. Phenylephrine Hydrochloride. In: McEvoy GK, ed. AHFS Drug Information,
2014. Bethesda: American Society of Health System Pharmacists, 2014:1342–
1347.